Контроль эффективности работы стерилизаторов осуществляют бактериологическим методом, используя биотесты на основании гибели спор тест-культуры.
Биотесты представляют собой флаконы из трубки стеклянной для лекарственных средств ФИ/1-5 НС 1 ТУ 64-0709-10-88 (инсулиновые флаконы) или чашечки из алюминиевой фольги (диск размером 14 мм с луночкой-вдавлением от не оточенного края карандаша), содержащие высушенные споры тест-культуры Вас. stearothermophilus ВКМ В-718, помещенные в пакеты из упаковочной бумаги (ОСТ 42-21-2-85). Упакованные тесты нумеруют и размещают в контрольные точки паровых стерилизаторов (5-10 тестов). По окончании стерилизации биотесты подвергают бактериологическому исследованию.
2. Штамм Вас. stearothermophilus ВКМ В-718 - подвижная термофильная палочка, по Граму окрашивается положительно, культивируется при температуре  °С, исключающей развитие других широко распространенных микроорганизмов. Споры овальные, расположенные центрально. На мясопептонном бульоне (рН
°С, исключающей развитие других широко распространенных микроорганизмов. Споры овальные, расположенные центрально. На мясопептонном бульоне (рН  ) через 24 часа образует помутнение среды, на мясо-пептонном агаре (рН
) через 24 часа образует помутнение среды, на мясо-пептонном агаре (рН  ) - слабо выпуклые колонии диаметром 2-4 мм с ровным краем. Штамм не патогенен для человека и животных. Штамм получен из Всесоюзной коллекции микроорганизмов института биохимии и физиологии микроорганизмов, хранится в музее культур НИИ дезинфектологии (117246, г. Москва, Научный проезд, 18).
) - слабо выпуклые колонии диаметром 2-4 мм с ровным краем. Штамм не патогенен для человека и животных. Штамм получен из Всесоюзной коллекции микроорганизмов института биохимии и физиологии микроорганизмов, хранится в музее культур НИИ дезинфектологии (117246, г. Москва, Научный проезд, 18).
Приготовление биотеста
В ампулу с лиофилизированной культурой вносят 0,2 мл стерильной водопроводной воды и оставляют на 30 мин при комнатной температуре.
Одну-две капли культуры засевают в 2 пробирки с бульоном (МПБ, Хоттингера, бульон питательный сухой) с 0,5% глюкозы. Суточную бульонную культуру засевают в пробирки на скошенный агар (Хоттингера, мясопептонный, сухой питательный). Для получения спор культуру, выращенную на твердой питательной среде, смывают 5 мл стерильной водопроводной воды и переносят во флаконы со скошенным картофельно-пептонным агаром. Взвесь покачиванием флакона равномерно распределяют по поверхности среды, инкубируют при 55°С в течение 10-12 суток в наклонном положении агаром вверх. Для создания достаточной влажности в термостат помещают открытые емкости с водой. На 7, 10 и 12 сутки культуру проверяют на интенсивность спорообразования. Достаточным количеством считают 80-90% спор в поле зрения. Культуру смывают стерильной дистиллированной водой. В целях освобождения от вегетативных клеток суспензию прогревают на водяной бане при температуре 65-70°С течение 30 мин, центрифугируют трехкратно с частотой вращения 33, 33с-1 (2000 об./мин) по 15 мин, промывая осадок стерильной дистиллированной водой после каждого центрифугирования. Отмытые споры суспендируют в стерильной дистиллированной воде в соотношении 1:1 по объему. Суспензию спор хранят в холодильнике при температуре 4°С в стерильных пробирках, закрытых ватно-марлевыми пробками с резиновыми колпачками (срок хранения 2 года).
Чистоту культуры на всех этапах культивирования контролируют высевом на агаровые пластинки.
Для определения титра жизнеспособных спор 0,1 мл исходной суспензии десятикратно разводят до  стерильной дистиллированной водой, высевая на 3 агаровые пластинки по 0,1 мл ориентировочно из
стерильной дистиллированной водой, высевая на 3 агаровые пластинки по 0,1 мл ориентировочно из 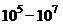 (предел разведения зависит от титра полученных спор). Посевы инкубируют в течение 48 часов, проводят подсчет выросших колоний. Титр жизнеспособных спор в исходной суспензии определяют как среднее арифметическое число колоний с учетом разведения исходной суспензии и объема пробы для посева.
(предел разведения зависит от титра полученных спор). Посевы инкубируют в течение 48 часов, проводят подсчет выросших колоний. Титр жизнеспособных спор в исходной суспензии определяют как среднее арифметическое число колоний с учетом разведения исходной суспензии и объема пробы для посева.
Например, при посеве на три чашки Петри с агаром суспензии в разведении 1:100000  , подсчитано 140, 110 и 134 колонии. Аналогичные высевы из разведении
, подсчитано 140, 110 и 134 колонии. Аналогичные высевы из разведении 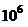 привели к образованию 12, 14 и 16 колоний; из
привели к образованию 12, 14 и 16 колоний; из  - 5, 3 и 7 колоний. Вычисляем общее число колоний, а затем среднее количество колоний для каждого разведения 128, 14 и 5.
- 5, 3 и 7 колоний. Вычисляем общее число колоний, а затем среднее количество колоний для каждого разведения 128, 14 и 5.
Из расчета посевной дозы (0,1 мл на каждую чашку) вычисляем титр жизнеспособных спор в 1 мл исходной суспензии с учетом разведения, далее находим среднее арифметическое число колоний:
Таким образом, титр исходной суспензии составит:
| | |
| 232 × 28 пикс. Открыть в новом окне | |
Исходная суспензия должна содержать не менее  спор в 1 мл. Споры в количестве
спор в 1 мл. Споры в количестве  вносят из исходной суспензии с помощью дозатора пипеточного (ТУ 64-1-3329-81) в 0,02 мл в носители (стерильные инсулиновые флакончики с ватно-марлевой пробкой или чашечки из алюминиевой фольги, разложенные в чашки Петри), подсушивают в термостате при 37°С или в эксикаторе над осушителем (силикагель, хлористый кальций) при комнатной температуре в течение 24 часов.
вносят из исходной суспензии с помощью дозатора пипеточного (ТУ 64-1-3329-81) в 0,02 мл в носители (стерильные инсулиновые флакончики с ватно-марлевой пробкой или чашечки из алюминиевой фольги, разложенные в чашки Петри), подсушивают в термостате при 37°С или в эксикаторе над осушителем (силикагель, хлористый кальций) при комнатной температуре в течение 24 часов.
Для определения фактической обсемененности исследуют не менее трех биотестов от каждой группы. Во флаконы (чашечки) вносят по 1,0 мл стерильной дистиллированной воды (чашечки из алюминиевой фольги, отмывают в широкогорлых пробирках с бусами в 10 мл) и встряхивают в течение 10 мин на аппарате для встряхивания жидкостей с последующим высевом на 3 агаровые пластинки по 0,1 мл суспензии из трех последовательных десятикратных разведении.
3. Определение устойчивости спор тест-культур к действию водяного насыщенного пара под избыточным давлением проводят при температуре  °С.
°С.
Биотесты в упаковочной бумаге помещают в стерилизационной коробке в камеру парового стерилизатора. После набора давления в водопаровой камере  МПа (
МПа (
 ) проводят продувку парового стерилизатора (вытеснение воздуха паром из камеры парового стерилизатора) в течение 10 мин при открытом спускном кране и давлении в стерилизационной камере от 0,01 до 0,02 МПа (от 0,1 до 0,2
) проводят продувку парового стерилизатора (вытеснение воздуха паром из камеры парового стерилизатора) в течение 10 мин при открытом спускном кране и давлении в стерилизационной камере от 0,01 до 0,02 МПа (от 0,1 до 0,2  ). После продувки доводят давление пара в стерилизационной камере до
). После продувки доводят давление пара в стерилизационной камере до  МПа (
МПа (
 ), температура
), температура  °С и через 5 мин (времени выживания спор тест-культуры) с момента установления давления спускают пар. Для уменьшения времени воздействия пара до и после экспозиции подъем давления проводят максимум в течение 8 мин, спуск - в течение 3 мин.
°С и через 5 мин (времени выживания спор тест-культуры) с момента установления давления спускают пар. Для уменьшения времени воздействия пара до и после экспозиции подъем давления проводят максимум в течение 8 мин, спуск - в течение 3 мин.
Аналогичное исследование проводят в течение 15 мин времени выдержки (время гибели спор тест-культуры). Контроль температуры осуществляют максимальными термометрами. По окончании времени выдержки биотесты вынимают из стерилизатора и проводят бактериологическое исследование.
Партию биотестов считают годными для использования, если показатели устойчивости спор тест-культуры соответствуют вышеописанным требованиям.
4. Для определения эффективности работы стерилизатора в обеззараженные биотесты и контрольный тест (без стерилизации) стерильно вносят по 5 мл питательной среды, инкубируют при 55°С в течение 7 суток при ежедневном просмотре посевов, делая высевы на агаровые пластинки из проросших емкостей.
При использовании полусинтетической среды с индикатором феноловым красным рост тест-культуры определяют по изменению красного цвета среды (рН  ) на желто-оранжевый (рН
) на желто-оранжевый (рН 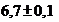 ) за счет разложения глюкозы с образованием кислоты.
) за счет разложения глюкозы с образованием кислоты.
В целях исключения ложного отрицательного результата (при наличии роста тест-культуры отсутствует изменение цвета питательной среды) флаконы (пробирки) должны быть плотно закрыты стерильными резиновыми пробками (N 7,5; 12,5).
Отсутствие роста тест-культуры указывает на эффективность работы стерилизатора. Рост других культур микроорганизмов относят за счет вторичного обсеменения.
При наличии роста тест-штаммов проводится повторный контроль на удвоенном количестве биотестов. Если и при повторной проверке тест-культуры не инактивируются, осуществляют тщательный контроль технического состояния аппарата и контрольно-измерительных приборов. При отсутствии роста тест-культур в контрольном биотесте (не подвергшемся стерилизации) устанавливается причина (нежизнеспособность тест-культуры, несоблюдение методики приготовления биотестов, питательных сред, условий культивирования).
5. Для спорообразования используют:
- картофельно-пептонный агар (пептон - 5,0, мел - 1,0, агар - 25,0, картофельная вода - 1 000 мл), рН  . Сырой картофель (200 г очищенного картофеля на 1 л водопроводной воды) тщательно моют, очищают от кожуры и глазков, нарезают мелкими ломтиками, заливают водопроводной водой и кипятят 30 мин после закипания (молодой картофель употреблять нельзя). Отвар отстаивают и фильтруют в холодном состоянии через ватно-марлевый фильтр. Доводят объем фильтрата до первоначального. Устанавливают рН
. Сырой картофель (200 г очищенного картофеля на 1 л водопроводной воды) тщательно моют, очищают от кожуры и глазков, нарезают мелкими ломтиками, заливают водопроводной водой и кипятят 30 мин после закипания (молодой картофель употреблять нельзя). Отвар отстаивают и фильтруют в холодном состоянии через ватно-марлевый фильтр. Доводят объем фильтрата до первоначального. Устанавливают рН  . Добавляют пептон и агар. Нагревают, помешивая до полного расплавления агара, фильтруют через ватно-марлевый фильтр, после чего добавляют мел. Разливают по флаконам, стерилизуют при 120°С в течение 30 мин. После стерилизации среду во флаконах скашивают;
. Добавляют пептон и агар. Нагревают, помешивая до полного расплавления агара, фильтруют через ватно-марлевый фильтр, после чего добавляют мел. Разливают по флаконам, стерилизуют при 120°С в течение 30 мин. После стерилизации среду во флаконах скашивают;
- пшеничный агар (пшеничная крупа - 500,0, агар - 25,0, дистиллированная вода - 1 000 мл), рН-  .
.
Пшеничную крупу заливают дистиллированной водой. Через 12 часов настой аккуратно сливают, не выжимая, доводят до первоначального объема, добавляют агар и растапливают на водяной бане или в автоклаве (текучим паром 1 час). Остывший агар выкладывают на противень и срезают осадок. Агар растапливают на водяной бане, постоянно помешивая. Устанавливают рН  . Разливают во флаконы. Стерилизуют текучим паром по 1 часу в течение 3 суток. После стерилизации среду скашивают.
. Разливают во флаконы. Стерилизуют текучим паром по 1 часу в течение 3 суток. После стерилизации среду скашивают.
6. Для контроля используют бульон Хоттингера рН  , агар Хоттингера рН
, агар Хоттингера рН  , питательный бульон сухой рН
, питательный бульон сухой рН  , питательный агар сухой рН
, питательный агар сухой рН  , среду питательную для контроля стерильности рН
, среду питательную для контроля стерильности рН  , бульон из перевара кровяных сгустков, полусинтетическую среду с индикатором феноловым красным рН
, бульон из перевара кровяных сгустков, полусинтетическую среду с индикатором феноловым красным рН 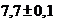 (аммоний фосфорно-кислый однозамещенный -
(аммоний фосфорно-кислый однозамещенный -  - 1,0 г; магний серно-кислый -
- 1,0 г; магний серно-кислый - 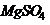 - 0,2 г, калий хлористый - KCl - 0,2 г, глюкоза - 5,0 г, феноловый красный - 0,02 г, бульон Хоттингера с содержанием аминного азота - 140-160 мг - 200 мл, дистиллированная вода - 800 мл, рН
- 0,2 г, калий хлористый - KCl - 0,2 г, глюкоза - 5,0 г, феноловый красный - 0,02 г, бульон Хоттингера с содержанием аминного азота - 140-160 мг - 200 мл, дистиллированная вода - 800 мл, рН  . Компоненты смешивают и растворяют при нагревании на водяной бане, доводят рН до
. Компоненты смешивают и растворяют при нагревании на водяной бане, доводят рН до  , разливают во флаконы, стерилизуют при 110°С в течение 30 мин.
, разливают во флаконы, стерилизуют при 110°С в течение 30 мин.
Химические тесты для контроля температурных параметров режимов работы воздушных стерилизаторов (1)
N п/п | Наименование химического соединения | Цвет, форма кристаллов, запах | Нормативно-техническая документация | Количество компонента, грамм | Температурный параметр, подлежащий контролю,°С | |
160-10°С 160+2°С | 180-10°С 180+2°С | |||||
1 | Левомицет ин(2) | Белый или белый со слабым желтовато -зеленоватым оттенком кристаллический порошок без запаха | ГФ Х (3) ст.371 | 100,0 | +(4) | |
2 | Кислота винная | Порошок белого цвета или прозрачные бесцветные кристаллы | ГОСТ 5817-77 ГОСТ 21205-83 | 100,0 | - | + |
3 | Гидрохино н | Бесцветные или светло-серые серебристые кристаллы | ГОСТ 19627-74 | 100,0 | - | + |
4 | Тиомочеви на | Блестящие бесцветные кристаллы | ГОСТ 6344-73 | 100,0 | - | + |
| Примечание:1 - В состав химических тестов, используемых для контроля работы воздушных стерилизаторов, краситель не добавляют, т. к. указанные химические соединения изменяют свой цвет при достижении температуры плавления;2 - Относится к сильнодействующим лекарственным средствам, применение и хранение которых должно проводиться с предосторожностью, хранение в закрытых шкафах в сухом помещении;3 - ГФ X - Государственная Фармакопея СССР, X издание;4 - "+" - температурный параметр, для контроля используют химическое соединение. | ||||||
Химические индикаторы в паровом стерилизаторе размещают в каждой обеззараживаемой ёмкости и два - в самой камере, в воздушных стерилизаторах - от 5 до 15 в зависимости от ёмкости камеры.
Приложение 8
к СП 1.3.3118-13
к СП 1.3.3118-13
Порядок замены фильтров очистки воздуха вытяжной и приточной систем вентиляции и определения их защитной эффективности
1. Замену фильтров очистки воздуха (ФОВ) приточных и вытяжных систем проводят в процессе планово-предупредительных ремонтов при достижении предельно допустимого перепада давлений, установленного проектом или службой главного инженера организации, исходя из требований не превышения (исключения возможности превышения):
Предельно допустимое сопротивление фильтрующих элементов, по условиям прочности фильтрующего материала для предотвращения его повреждения, не должно превышать:
- 1 500 Па (150 мм в. ст.) для фильтров из ткани ФПП (фильтрующее полотно Петрянова);
- 450 Па для НЕРА фильтров, 600 Па для ULPA фильтров (в соответствии с требованиями ГОСТ 51251-99 п.п. 5.3.2).
Замена фильтров очистки воздуха других типов осуществляется при увеличении исходного сопротивления фильтра при номинальной производительности в 2 раза.
Внеплановые замены фильтров очистки воздуха осуществляются в случаях превышения нормативного значения коэффициентов проницаемости.
Критическим сопротивлением для ФОВ является увеличение сопротивления в 2 раза по отношению к начальному при условии, что оно не более:
- предельно допустимого сопротивления ФОВ по условиям прочности фильтрующего материала для предотвращения его повреждения, которое принимается в соответствии с рекомендациями санитарных правил, но не более сопротивления, указанного в паспортных данных конкретного фильтра;
- предельно допустимого сопротивления ФОВ по условиям поддержания проектных параметров, указанного в проекте и/или паспорте вентиляционной установки;
- предельно допустимого сопротивления ФОВ, указанного в паспортных данных конкретного фильтра.
2. Перед демонтажем проводят предварительную дезинфекцию фильтра и магистрального воздуховода парами формалина либо аэрозольным способом (Приложение 1).
3. Распыление дезинфектанта осуществляется при работающей вентиляции. По окончании распыления вентиляция выключается и по истечении времени экспозиции фильтр может быть снят.
4. Работу по демонтажу фильтра проводят в костюме IV типа с использованием резиновых перчаток (под рабочими рукавицами) и респиратора.
5. Снятый фильтр помещают в крафт-мешок или другую упаковку и переносят для автоклавирования или сжигания в установленном порядке.
 ar-net.ru
ar-net.ru